عملکرد پانکراس در تنظیم قند خون: از انسولین تا گلوکاگون
- Shekarban
- دیابت نوع دو, دیابت نوع یک
پانکراس یا لوزالمعده غدهای چندکارکردی در بدن انسان است که هم در گوارش و هم در تنظیم تعادل متابولیک نقش بنیادی دارد. پانکراس که میان معده و دوازدهه جای دارد از دو بخش درونریز و برونریز ساخته شده است. بخش برونریز، آنزیمهای گوارشی ترشح میکند تا چربی و پروتئین را تجزیه کند، حال آنکه بخش درونریز با ترشح دو هورمون کلیدی انسولین و گلوکاگون (نگهبان اصلی توازن قند خون؛ انسولین موجب کاهش قند خون میشود و در مقابل گلوکاگون موجب افزایش آن میشود) را تولید و ترشح میکند. این تنظیم دقیق، که اغلب آن را «هموستاز گلوکز» نامیده میشود، حیاتیترین فرآیند متابولیک برای تامین انرژی پایدار مغز و سایر اندامهاست. در این نوشتار از مجله شکربان به بررسی عملکرد پانکراس در تنظیم قند خون و نکات مرتبط با آن پرداخته شده است.
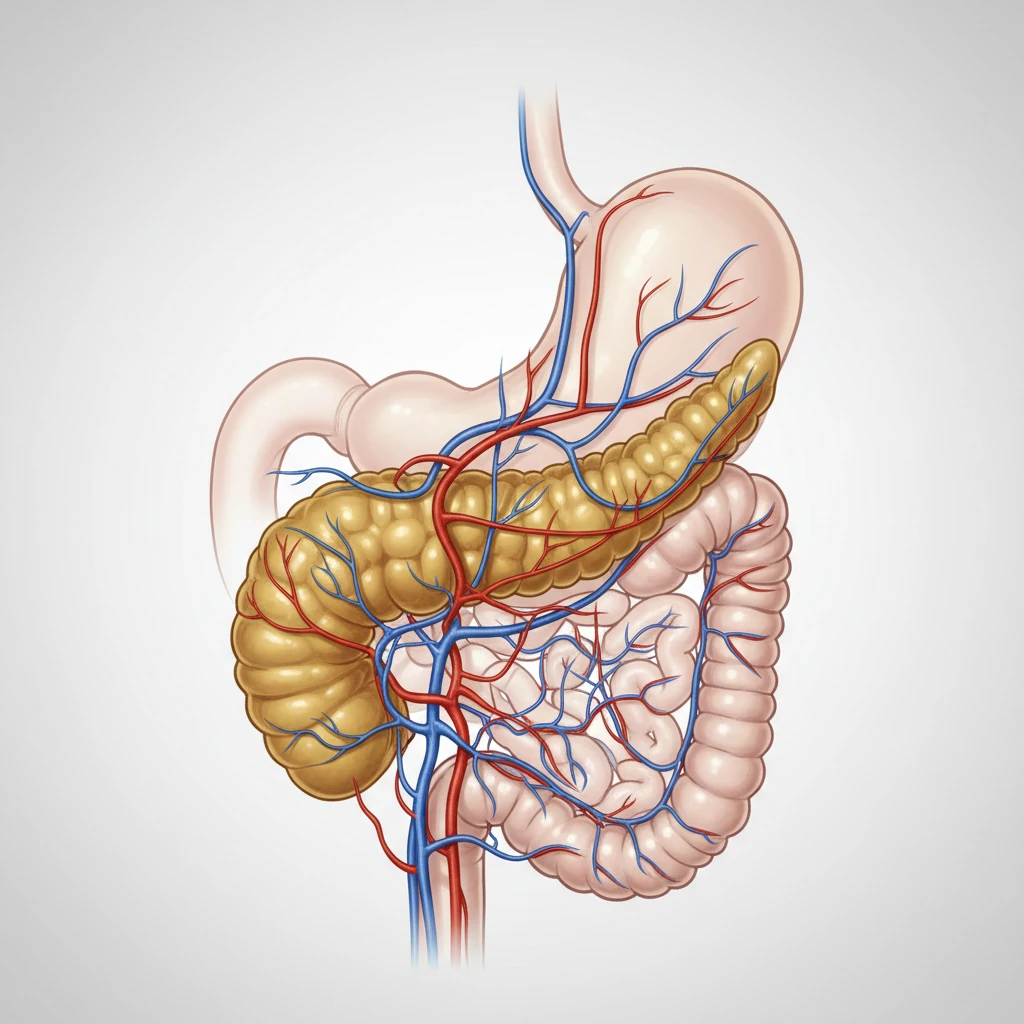
بخش اول: ساختار پانکراس (جزایر لانگرهانس)
وظایف تنظیم قند خون در پانکراس بر عهده ساختارهای تخصصی بهنام جزایر لانگرهانس است. این جزایر که تنها حدود ۱ تا ۲ درصد از توده پانکراس را تشکیل میدهند، در واقع خوشههایی از سلولهای غددی هستند که در میان بافت برونریز (آسینار) پخش شدهاند. در یک فرد بالغ سالم، حدود یک میلیون جزیره لانگرهانس وجود دارد که هر کدام دارای تراکمهای متفاوتی از سلولهای اصلی زیر هستند:
- سلولهای بتا (beta) حدود ۶۰ تا ۸۰ درصد از کل سلولهای جزیره را تشکیل میدهند و مسئول ترشح انسولین هستند. این سلولها معمولا در مرکز جزیره قرار دارند؛
- سلولهای آلفا (alpha) حدود ۱۵ تا ۲۰ درصد را تشکیل داده و مسئولیت تولید و ترشح گلوکاگون را برعهده دارند. این سلولها اغلب در محیط یا حاشیه جزایر لانگرهانس قرار میگیرند؛
- سلولهای دلتا (delta) حدود ۵ تا ۱۰ درصد را تشکیل داده و سوماتواستاتین (هورمون مهارکننده) را ترشح میکنند. سوماتواستاتین (Somatostatin) هورمونی است که نقش ترمز یا تنظیمکننده بازدارنده در سامانهی غدد درونریز را برعهده دارد. یعنی وظیفهاش این است که وقتی دیگر هورمونها بیش از اندازه فعال میشوند، آنها را مهار کند تا بدن دچار آشفتگی نشود؛
- سلولهای افپی (PP cells) درصد کمی را شامل شده و پپتید پانکراسی را ترشح میکنند. پپتید پانکراسی» یا Pancreatic Peptide در واقع چهارمین هورمون اصلی جزایر لانگرهانس پانکراس است (سه هورمون دیگر عبارتند از انسولین، گلوکاگون و سوماتواستاتین). به بیان سادهتر در جزایر لانگرهانس سلولهای خاصی وجود دارند بهنام سلولهای پی (PP cells) یا سلولهای F. این سلولها بیشتر در بخش انتهایی پانکراس یعنی نزدیک دوازدهه تجمع دارند و هورمونشان را پس از خوردن غذا (بهویژه پروتئینها). ترشح میکنند. این پپتید مانند سوماتواستاتین، تنظیمکننده تعادل است و بیشتر اثر مهارکننده دارد. مهمترین کارکردهای آن عبارتند از:
- کاهش ترشح صفرا و آنزیمهای گوارشی از پانکراس بیرونی (بخش برونریز)؛
- کاهش حرکات معده و روده (اثری آرامکننده دارد)؛
- مهار ترشح گاسترین و ترشح شیرههای گوارشی معده؛
- تنظیم احساس سیری و دستکاری متابولیسم چربیها.
در حقیقت، پس از مصرف مواد خوراکی و آغاز هضم آنها، پپتید پانکراسی مانند «طبیب مهربان» وارد عمل میشود تا گوارش بیش از حد سریع یا پرانرژی نباشد.
این سلولها از طریق سیستم عروقی و اتصالات الکتریکی (Gap Junctions) با یکدیگر در ارتباط هستند و میتوانند ترشحات یکدیگر را بهصورت مستقیم تحت تاثیر قرار دهند؛ این امر مکانیسم بازخورد لحظهای را برای تنظیم قند خون فراهم میسازد.
انسولین: فرشته فرود آمده در عصر قندهای سرگردان
انسولین یک هورمون پپتیدی کوچک است که از پیشساز پروتئینی بزرگی به نام پرواینولین (Proinsulin) ساخته میشود. این پرواینولین پس از خروج از شبکه آندوپلاسمی، در دستگاه گلژی به انسولین فعال و پپتید C تقسیم میشود. میزان ترشح پپتید C یک شاخص عالی برای اندازهگیری میزان تولید واقعی انسولین در بدن است، زیرا پپتید C به همان اندازه انسولین در خون ترشح میشود.
مکانیسم ترشح انسولین و ارتباط آن با دیابت
ترشح انسولین یک فرآیند هوشمند و کاملا وابسته به غلظت گلوکز یا همان قند خون است. این کار ظریف را سلولهای بتا (β-cells) جزایر لانگرهانس پانکراس انجام میدهند. برای افرادی که دیابت دارند، آشنایی با این روند به درک بهتر شرایط و رفتار بدنشان کمک بسیار میکند.
- جذب گلوکز توسط سلول بتا هنگامی که پس از غذا خوردن سطح قند خون افزایش مییابد، مولکولهای گلوکز از طریق ناقل غشایی مخصوص به نام GLUT2 وارد سلولهای بتا میشوند. این ناقل سرعت را محدود نمیکند، یعنی سلول بتا هر مقدار گلوکز خون که بالا رود را احساس میکند.
- متابولیسم گلوکز و تولید انرژی (ATP) درون سلول، گلوکز به کمک آنزیم گلوکوکیناز فعال میشود و وارد مسیر گلیکولیز میگردد. این مسیر به تولید مولکولهای ATP (آدنوزین تریفسفات) منجر میشود -واحد انرژی سلول.
بهصورت نمادین:
بسته شدن کانالهای پتاسیمی وابسته به ATP
افزایش میزان ATP باعث بسته شدن کانالهای پتاسیمی حساس به ATP (K_{ATP} channels) روی غشای سلول بتا میشود. در افراد دارای تشخیص دیابت نوع ۲ بسیاری از داروهای خوراکی کاهش دهنده قند (مانند سولفونیل اورهها) همین مرحله را تقویت میکنند تا انسولین بیشتری ترشح شود. برای اطلاعات بیشتر در این رابطه میتوانید به نوشتار «داروهای خوراکی کاهنده قند خون» مراجعه کنید؛
- دپولاریزاسیون یا تحریک برقی سلول وقتی کانالهای پتاسیمی بسته میشوند، بار الکتریکی داخل سلول مثبتتر میشود. این تغییر را دپولاریزاسیون مینامند و یکی از لحظات کلیدی در فرآیند «روشنشدن» سلول بتا است.
- ورود کلسیم و آزاد شدن انسولین دپولاریزاسیون باعث باز شدن کانالهای کلسیمی وابسته به ولتاژ (Voltage-gated Ca²⁺ channels) میشود. ورود یونهای کلسیم به درون سلول، سیگنالی قوی برای حرکت وزیکولهای حاوی انسولین به سمت غشاء سلول است. این وزیکولها با غشاء ادغام میشوند و انسولین را به جریان خون آزاد میسازند.
💠 اهمیت این مکانیسم در دیابت
- در دیابت نوع ۱ سلولهای بتا تخریب شدهاند و این چرخه عملا از کار میافتد. بنابراین تزریق انسولین جایگزین عملکرد طبیعی میشود؛
- در دیابت نوع ۲، سلولها هنوز وجود دارند، ولی یا پاسخ ضعیفی به گلوکز (قند) میدهند یا بدن نسبت به انسولین مقاوم شده است. بنابراین مرحلههای ۲ و ۳ (تولید ATP و بسته شدن کانالها) اغلب ناکارآمد عمل میکنند.
این آگاهی به افراد دارای تشخیص دیابت کمک میکند تا متوجه شود چگونه رژیم غذایی، دارو، فعالیت بدنی و حتی خواب میتواند بر کیفیت پاسخ سلولهای بتا به گلوکز تأثیر بگذارد؛ به یعنی همان نقطهای که سرآغاز کنترل موثر دیابت و قند خون است.
عملکرد انسولین در سطح سلولی
انسولین پس از ورود به جریان خون به گیرندههای اختصاصی روی سلولهای هدف (عضله، چربی و کبد) متصل میشود و سلسلهای از پیامهای درون سلولی را فعال میکند. وظیفه اصلی آن کاهش قند خون از طریق سه مسیر است:
- افزایش جذب گلوکز انسولین در سلولهای ماهیچهای و چربی، مهاجرت و فعالسازی ناقلهای گلوکز نوع ۴ (GLUT4) را از سیتوپلاسم به سطح غشا تحریک میکند؛
- تثبیت ذخیرهسازی (گلیکوژنز) در کبد و عضله، انسولین آنزیم گلیکوژن سنتاز را فعال میکند که گلوکز را به شکل گلیکوژن ذخیره میکند. این فرآیند مصرف گلوکز اضافی را افزایش میدهد؛
- مهار تولید گلوکز (گلوکونئوژنز) انسولین یکی از مهمترین هورمونهای بدن برای تنظیم قند خون است. یکی از کارهای اصلی آن کمکردن ساخت قند اضافی در کبد است. شاید جالب باشد که بدانید حدود دو-سوم گلوکز دریافتی از هر وعده غذایی بهصورت گلیکوژن در کبد ذخیره شده و در فاصله میان وعدههای غذایی و بر اثر ترشح هورمون گلوکاگون به تدریج به گلوکز تجزیه شده و وارد جریان خون میشود. این فرآیند نقش مهمی در تامین انرژی بدن در فاصله میان وعدههای غذایی دارد. علاوهبر این، در حالت طبیعی، اگر بدن به اندازه کافی غذا دریافت نکرده باشد یا قند خون پایین بیاید، کبد از مواد دیگری مانند چربی و پروتئین قند تازه میسازد تا انرژی تامین شود. اما وقتی انسولین خون افزایش مییابد (بهعنوان مثال، بعد از خوردن غذا) بدن به کبد دستور میدهد که این فرآیند را متوقف کند. به این معنا که انسولین جلوی تبدیل چربیها و پروتئینها به قند را میگیرد تا مقدار قند در خون بیش از حد زیاد نشود. نتیجه این مهار آن است که غلظت قند خون ثابت و طبیعی باقی میماند و بدن دچار نوسان یا افزایش ناگهانی قند نمیشود.
پیامد مقاومت به انسولین در شرایط مقاومت به انسولین یا کاهش ترشح آن (همانند دیابت نوع ۲) سلولها دیگر به خوبی به سیگنالهای انسولین پاسخ نمیدهند. این امر باعث میشود گلوکز (قند) نتواند وارد بافتها شود و کبد نیز بهطور مداوم به تولید گلوکز ادامه دهد، در نتیجه قند خون بهصورت مزمن افزایش مییابد (هیپرگلیسمی).
گلوکاگون: ناجی روزهای کمقند
گلوکاگون هورمونی پپتیدی است که توسط سلولهای آلفای لوزالمعده ترشح میشود و عملکرد آن دقیقا در نقطه مقابل انسولین قرار دارد؛ کارکرد اصلی هورمون گلوکاگون افزایش قند خون در شرایط افت شدید قند خون (هیپوگلیسمی) است. در ادامه به بررسی نحوه تولید و ترشح و همچنین کارکردهای گلوکاگون پرداخته شده است.
محرک ترشح گلوکاگون
ترشح گلوکاگون عمدتا توسط دو عامل تحریک میشود:
- کاهش غلظت گلوکز خون این موضوع عامل اصلی ترشح گلوکاگون است. هنگامی که قند خون به زیر ۶۰ تا ۷۰ میلی گرم در دسی لیتر میرسد، سلولهای آلفا فعال شده و گلوکاگون را آزاد میکنند که منجر به افزایش قند خون میشود؛
- تحریکات سیستم عصبی پاراسمپاتیک و برخی آمینواسیدها شاید جالب باشد که بدانید دو عامل مصرف مواد خوراکی و استرس موجب افزایش قند خون میشود و در برخی موارد تاثیر استرس بر افزایش قند خون به مراتب از مصرف مواد خوراکی بیشتر است. برای آشنایی بیشتر با این موضوع میتوانید به نوشتار «مدیریت استرس و تاثیر آن بر قند خون» مراجعه کنید.
مکانیسم عملکرد گلوکاگون
گلوکاگون عمدتا بر کبد اثر میگذارد و فرآیندهای زیر را تحریک میکند تا ذخایر گلوکز را آزاد سازد. شاید جالب باشد که بدانید حدود دو-سوم گلوکز دریافتی از هر وعده غذایی بهصورت گلیکوژن در کبد ذخیره شده و در فاصله میان وعدههای غذایی و بر اثر ترشح هورمون گلوکاگون به تدریج به گلوکز تجزیه شده و وارد جریان خون میشود. این فرآیند نقش مهمی در تامین انرژی بدن در فاصله میان وعدههای غذایی دارد. در ادامه به بررسی مکانیسم عملکرد گلوکاگون پرداخته شده است.
- گلیکوژنولیز گلیکوژنولیز یعنی آزاد شدن سریع قند از ذخایر بدن، بهویژه از کبد و عضلات. به اینصورت که بدن قند اضافه را بهصورت مادهای به نام گلیکوژن نگه میدارد تا هر وقت نیاز به انرژی فوری داشت، از آن استفاده کند. در زمانهایی مانند گرسنگی طولانی، فعالیت شدید یا افت ناگهانی قند خون، بدن گلیکوژن را میشکند و آن را به قند ساده یعنی گلوکز تبدیل میکند. این قند وارد خون میشود و به سلولها انرژی میرساند. به همین دلیل، گلیکوژنولیز سریعترین راه برای بالا بردن قند خون در شرایط نیاز است؛
- گلوکونئوژنز (تولید گلوکز جدید) گلوکونئوژنز یعنی ساختن قند تازه در بدن، بهویژه زمانی که غذا یا قند آماده در دسترس نیست. در این فرآیند کبد از مواد غیرقندی مانند اسیدهای آمینه (از تجزیه پروتئینها) و لاکتات (که در عضلات هنگام ورزش ساخته میشود) استفاده میکند تا گلوکز جدید بسازد و وارد خون کند. هورمون گلوکاگون نقش اصلی را دارد؛ او به سلولهای کبد فرمان میدهد آنزیمهایی را بسازند که این تبدیل را انجام دهند. نتیجهاش این است که حتی وقتی مدت زیادی غذا نخوردهایم، قند خون پایین نمیآید و مغز و بدن انرژی لازم را دریافت میکنند.
اثر بر بافت چربی گلوکاگون لیپولیز (تجزیه چربیها) را نیز تحریک میکند، که این امر اسیدهای چرب آزاد را برای مصرف توسط بافتهای غیرمغزی فراهم میسازد و در نتیجه گلوکز خون را برای مصرف مغز حفظ میکند.
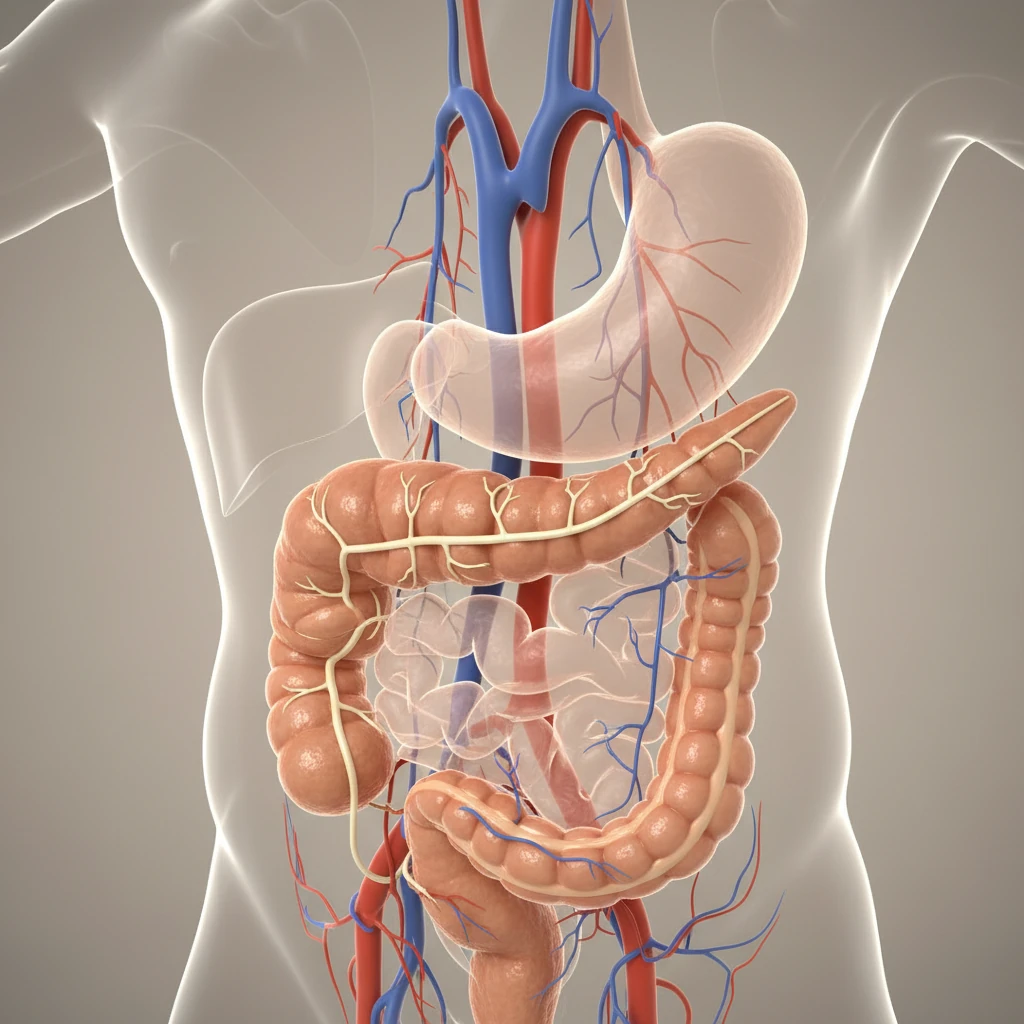
هماهنگی انسولین و گلوکاگون: چرخ تنظیم دوگانه
تنظیم قند خون مانند یک سیستم ترموستاتیک عمل میکند که توسط دو هورمون انسولین و گلوکاگون کنترل میشود. این تنظیم نهتنها بر اساس غلظت قند خون، بلکه بر اساس وضعیت تغذیهای بدن صورت میگیرد:
۱. بعد از صرف غذا (حالت سیری)
در این حالت، غلظت قند خون افزایش مییابد. در نتیجه، پانکراس مقدار زیادی انسولین ترشح میکند و در مقابل ترشح گلوکاگون کاهش مییابد.
نتیجه بدن شروع به جذب و ذخیره قند در سلولها و تبدیل آن به گلیکوژن و چربی میکند تا سطح قند خون به حد طبیعی برسد؛
۲. در زمان ناشتایی طولانی یا ورزش شدید در این وضعیت، غلظت قند خون کاهش پیدا میکند و ترشح انسولین کم میشود و در عوض ترشح گلوکاگون افزایش مییابد.
نتیجه گلوکاگون باعث آزادسازی گلوکز از ذخایر کبد و همچنین تحریک گلوکونئوژنز (تولید گلوکز جدید) میشود تا قند خون ثابت بماند؛
۳. در وضعیت نرمال (تعادل انرژی)
غلظت گلوکز در محدوده متوسط قرار دارد. ترشح انسولین و گلوکاگون متناسب با نیاز بدن تنظیم میشود.
نتیجه بدن در حالت تعادل قرار دارد و قند خون در سطح طبیعی حفظ میشود.
نقش هورمونهای کمکی در جزایر لانگرهانس
جزایر لانگرهانس فقط انسولین و گلوکاگون را تولید و ترشح نمیکنند؛ بلکه یک شبکه پیچیده پاراکراین برای تعدیل ترشحات اصلی دارند:
- سوماتوستاتین (از سلولهای دلتا) این هورمون یک مهارکننده عمومی است. سوماتوستاتین ترشح انسولین (در پاسخ به غذا) و ترشح گلوکاگون (در پاسخ به هیپوگلیسمی) را مهار میکند. این عمل به عنوان یک ترمز محلی عمل میکند تا از ترشح بیش از حد هر دو هورمون جلوگیری کند و اثر یکنواختتری بر قند خون اعمال نماید؛
- آمیلین این پپتید همراه انسولین ترشح میشود و اثر اصلی آن کند کردن تخلیه معده و افزایش احساس سیری است، که به کند شدن ورود گلوکز به خون کمک میکند؛
- پپتید پانکراسی (PP) این هورمون ترشح برونریز پانکراس (آنزیمهای گوارشی) را تحریک کرده و در شرایط پس از غذا، ترشح انسولین و گلوکاگون را تعدیل میکند، هرچند نقش اصلی آن در هموستاز گلوکز کمتر از دو هورمون اصلی است.
نارساییهای عملکرد پانکراس در تنظیم قند خون
هرگونه اختلال در تولید، ترشح، یا عملکرد گیرندههای انسولین میتواند منجر به بیماریهای جدی متابولیک شود، از جمله
۱. دیابت نوع 1 (Type 1 Diabetes Mellitus – T1DM)
مکانیسم یک بیماری خودایمنی است که در آن سیستم ایمنی بدن بهصورت انتخابی و تخریبی علیه سلولهای بتا تولیدکننده انسولین در جزایر لانگرهانس حمله میکند. این حمله منجر به تخریب گسترده و از بین رفتن تقریبا کامل توانایی تولید انسولین میشود.
پیامد بدن دچار کمبود مطلق انسولین میشود. در نتیجه، بدون تزریق خارجی انسولین، فرد دارای تشخیص دیابت دچار هیپرگلیسمی شدید (افزایش شدید قند خون)، دهیدراتاسیون و در صورت عدم درمان، کتواسیدوز دیابتی (DKA) خواهد شد.
۲. دیابت نوع 2 (Type 2 Diabetes Mellitus – T2DM)
مکانیسم دیابت نوع 2 شایعترین شکل دیابت است و نتیجه یک فرآیند دو مرحلهای است:
الف) مقاومت به انسولین بافتهای هدف (عضله، چربی، کبد) بهصورت موثر به انسولین پاسخ نمیدهند. این وضعیت غالبا با چاقی و سبک زندگی کمتحرک مرتبط است؛
ب) نارسایی سلول بتا در پاسخ به مقاومت به انسولین، پانکراس تلاش میکند با ترشح بیشتر انسولین (هیپرانسولینمی) این کمبود را جبران کند، اما با گذشت زمان، سلولهای بتا خسته شده و توانایی ترشح کافی انسولین را از دست میدهند.
پیامد هیپرگلیسمی (افزایش شدید قند خون) مزمن ناشی از ترکیبی از مقاومت بافتی و کمبود نسبی انسولین.
۳. هیپوگلیسمی (Hypoglycemia) یا افت شدید قند خون
این وضعیت زمانی رخ میدهد که قند خون بیش از حد پایین بیاید (معمولا زیر ۵۰ میلی گرم در دسی لیتر) که اغلب ناشی از درمان بیش از حد دیابت با انسولین یا داروهای محرک ترشح انسولین است.
مکانیسم ترشح بیش از حد انسولین یا ناکافی بودن پاسخ گلوکاگون به افت قند، منجر به مصرف سریع گلوکز و کمبود سوخت برای مغز میشود که علائمی چون لرزش، تعریق، گیجی و در موارد شدید کما را به دنبال دارد.
۴. تومورهای جزایر لانگرهانس
این تومورها که نادر هستند، باعث ترشح بیش از حد یک هورمون خاص میشوند:
- انسولینوما (یا ترشح بیش از حد انسولین) ترشح بیش از حد انسولین منجر به هیپوگلیسمی مکرر و شدید (افت مکرر قند خون) میشود.
- گلوکاگونما (Glucagonoma) گلوکاگونما یک تومور نادر در سلولهای آلفای جزایر لانگرهانس پانکراس است که باعث ترشح بیش از حد هورمون گلوکاگون میشود. گلوکاگون معمولا وظیفه دارد سطح قند خون را در زمان گرسنگی بالا نگه دارد، اما در گلوکاگونما این ترشح غیرطبیعی و کنترلنشده است و باعث تغییرات گسترده در بدن میشود. این تومور بیشتر در افراد میانسال یا سالمند دیده میشود و در اکثر موارد ماهیتی بدخیم دارد. علائم اصلی آن شامل افزایش قند خون و دیابت خفیف تا متوسط، کاهش شدید وزن، ضایعه پوستی خاصی به نام درماتیت نکروزان مهاجر (که بهصورت دایرههای قرمز و پوستهدار روی پوست ظاهر میشود)، کمخونی، التهاب زبان، اسهال مزمن و ضعف عمومی بدن است. تشخیص بیماری معمولا با اندازهگیری سطح گلوکاگون خون، انجام سیتیاسکن یا MRI پانکراس و در برخی موارد بیوپسی بافت انجام میشود. درمان اصلی خارج کردن تومور از طریق جراحی است و در موارد پیشرفته از داروهایی مانند سوماتواستاتین (اکتروتاید) برای مهار ترشح گلوکاگون و داروهای تنظیمکننده قند خون، درمان ضایعات پوستی و اصلاح تغذیه استفاده میشود.
درد پانکراس کجاست؟
درد پانکراس معمولا در قسمت بالایی شکم، زیر جناغ سینه و کمی متمایل به سمت چپ احساس میشود. این درد اغلب عمیق، ثابت و سوزاننده است و تمایل دارد به پشت، بهویژه بین دو کتف، منتشر شود. بسیاری از افراد توصیف میکنند که درد از شکم به پشت تیر میکشد و با دراز کشیدن شدت میگیرد، اما وقتی بدن کمی به جلو خم میشود، تا حدی آرام میشود. در موارد التهاب یا آسیب پانکراس، ممکن است همراه با تهوع، استفراغ و نفخ نیز باشد. ویژگی شاخص این درد آن است که معمولا با داروهای معده یا آنتیاسیدها کاهش نمییابد و از دردهای ناشی از معده یا زخم اثنیعشر قابل تفکیک است.
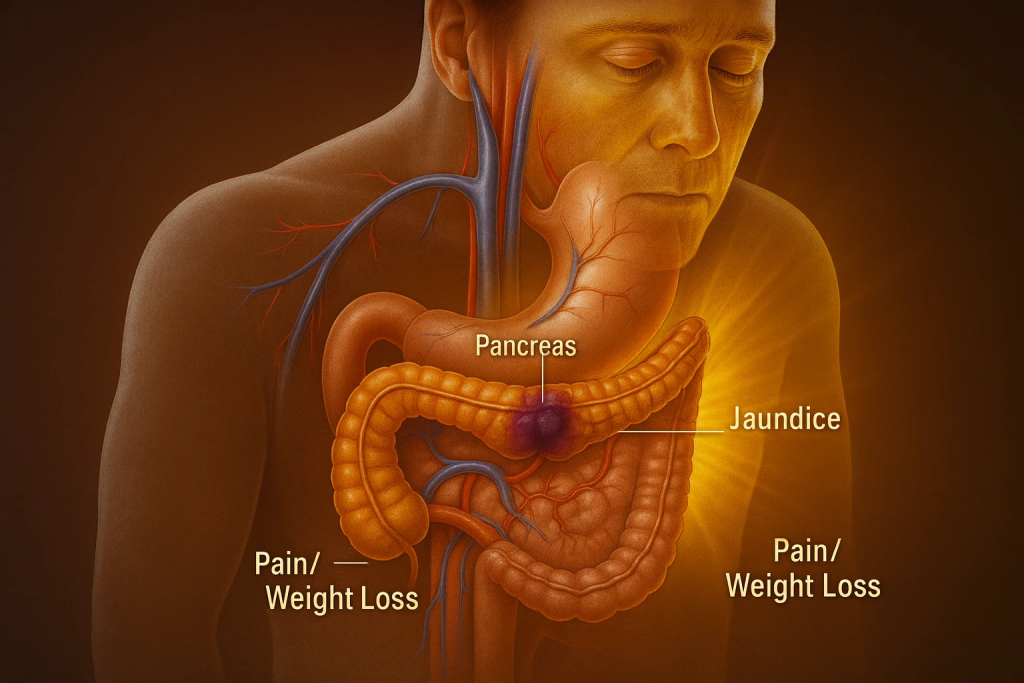
علائم سرطان پانکراس
سرطان پانکراس معمولا در مراحل اولیه علائم واضحی ندارد و به همین دلیل اغلب دیر تشخیص داده میشود. با پیشرفت بیماری، نشانههایی ظاهر میشوند که بسته به محل تومور و میزان گسترش آن متفاوتند، اما چند علامت مهم تقریبا در بیشتر بیماران دیده میشود.
در اغلب موارد، اولین علامت ممکن است درد مبهم در قسمت بالای شکم یا پشت باشد که بهتدریج شدت پیدا میکند و با دراز کشیدن بدتر میشود. بهمرور، فرد دچار کاهش وزن غیرمنتظره، زردی پوست و چشمها، خستگی و بیاشتهائی میشود.
نشانههای اصلی سرطان پانکراس عبارتاند از:
درد در ناحیه بالای شکم یا پشت، معمولا دائمی و افزایشی
- زردی پوست و چشمها (یرقان) بهعلت انسداد مجرای صفراوی توسط تومور؛
- کاهش وزن و ضعف شدید بدون علت مشخص؛
- تغییر در رنگ مدفوع و ادرار (مدفوع کمرنگ و چرب، ادرار تیره)؛
- تهوع، نفخ، بیاشتهایی و احساس پری معده حتی بعد از غذاهای سبک؛
- گاهی ایجاد دیابت جدید یا بدتر شدن دیابت قبلی بدون دلیل مشخص.
و در مراحل پیشرفتهتر، درد شدید پشت، خارش پوست، لخته شدن خون در وریدها یا افسردگی ناگهانی نیز دیده میشود.
اگر این علائم بیش از چند هفته ادامه داشته باشند، بهویژه در فردی بالای ۵۰ سال یا دارای سابقهی سیگار، چاقی یا سابقه خانوادگی سرطان پانکراس، مراجعه به پزشک و انجام تصویربرداری (مانند سونوگرافی، CT یا MRI) ضروری است.
علائم سرطان پانکراس در آزمایش خون
در آزمایش خون، سرطان پانکراس بهطور مستقیم با یک تست ساده تشخیص داده نمیشود، اما میتواند با تغییرات خاصی در شاخصهای آزمایشگاهی همراه باشد که هشداردهنده وجود مشکل جدی در این اندام هستند. یکی از مهمترین تغییرات، افزایش سطح بیلیروبین خون است که معمولا به دلیل انسداد مجرای صفراوی توسط تومور رخ میدهد و میتواند با زردی پوست و چشمها همراه باشد. علاوهبر بیلیروبین، افزایش آنزیمهای کبدی مانند ALT و AST و بهویژه ALP نیز مشاهده میشود که نشانه فشار یا انسداد در مسیر صفرا محسوب میگردد.
وجود اختلال در سطح قند خون یا تشخیص دیابت جدید، بهویژه در افراد بدون سابقه قبلی، میتواند یکی از پیامهای غیرمستقیم سرطان پانکراس باشد، زیرا این اندام در تنظیم انسولین و گلوکاگون نقش اساسی دارد. در برخی افراد، مارکر توموری CA 19-9 به میزان قابلتوجهی بالا میرود؛ هرچند این شاخص قطعی برای تشخیص نیست و بیشتر بهعنوان ابزار پیگیری و ارزیابی پاسخ به درمان استفاده میشود.
از دیگر تغییرات احتمالی در آزمایش خون میتوان به وجود نشانههای التهاب مزمن، کاهش آلبومین و گاهی کمخونی اشاره کرد که میتوانند ناشی از اثرات عمومی تومور بر بدن یا از دست دادن اشتها و سوءتغذیه باشند. در مجموع، ترکیب این یافتهها همراه با علائم بالینی، پزشک را به تصویربرداری دقیق و بررسی همراه با آزمایشهای تخصصی هدایت میکند تا وجود یا عدم وجود سرطان پانکراس مشخص شود.
کار پانکراس چیست؟
پانکراس یا لوزالمعده یکی از اندامهای مهم بدن است که دو وظیفهی اصلی و حیاتی دارد: کارکرد گوارشی و کارکرد هورمونی در تنظیم قند خون.
در بخش گوارشی، پانکراس آنزیمهایی تولید میکند که برای هضم چربیها، پروتئینها و کربوهیدراتها ضروری هستند. این آنزیمها از طریق مجرای پانکراسی به دوازدهه (ابتدای رودهی باریک) میریزند و مواد غذایی را به مولکولهای قابل جذب تبدیل میکنند. بدون عملکرد درست این بخش، هضم غذا ناقص و جذب مواد مغذی کاهش مییابد. در بخش درونریز یا هورمونی، سلولهای خاصی به نام جزایر لانگرهانس درون پانکراس وجود دارند که هورمونهای حیاتی تولید و ترشح میکنند:
- انسولین توسط سلولهای بتا ترشح میشود و باعث کاهش قند خون با ورود گلوکز به سلولها میگردد؛
- گلوکاگون از سلولهای آلفا ترشح میشود و عملکرد آن بالعکس انسولین است و قند خون را در زمان ناشتایی بالا میبرد؛
- سلولهای دیگری هم مانند سلولهای دلتا (تولید سوماتوستاتین) و سلولهای PP در تنظیم عملکرد دستگاه گوارش نقش دارند.
در نتیجه، پانکراس همزمان در دو سیستم مهم بدن فعال است (گوارش و متابولیسم قند) و اختلال در عملکرد آن، مانند التهاب یا تومور، میتواند منجر به اختلال هضم، کاهش وزن، و تغییر سطح قند خون شود.

برای درمان پانکراس چه بخوریم؟
برای سلامت و درمان پانکراس (بهویژه در شرایط التهاب یا ضعف عملکرد آن) تغذیه مناسب نقش بسیار مهمی دارد. رژیم غذایی باید به گونهای باشد که فشار متابولیکی کمی بر این اندام وارد کند و در عین حال مواد ضدالتهاب و ترمیمکننده را فراهم آورد. در مرحله بهبود یا پیشگیری، بهترین الگوی تغذیه شامل غذاهای سبک، طبیعی و کمچرب است. چربیهای زیاد، الکل و غذاهای سرخکردنی باعث تحریک ترشح زیاد آنزیمهای پانکراس میشوند و میتوانند التهاب را تشدید کنند. بنابراین، لازم است تا حد امکان از آنها دوری شود.
غذاهای مفید برای پانکراس عبارتاند از:
✅ میوهها و سبزیجات تازه مانند کلم بروکلی، اسفناج، هویج، سیب و پرتقال که سرشار از آنتیاکسیداناند و از سلولهای پانکراس در برابر آسیب محافظت میکنند؛
✅ غلات کامل مانند جو دوسر و برنج قهوهای؛ این مواد هضم راحتتری دارند و قند خون را بهآرامی بالا میبرند، در نتیجه فشار متابولیکی کمتری بر سلولهای بتا وارد میشود؛
✅ پروتئینهای سبک مانند ماهی سفید، مرغ بدون پوست و حبوبات پختهشده؛ بجای گوشت قرمز پرچرب؛
✅ مصرف روغنهای سالم مانند روغن زیتون یا آووکادو بجای روغنهای صنعتی یا حیوانی؛
✅ نوشیدن آب کافی و پرهیز از نوشابههای صنعتی و قندهای ساده مانند شیرینیها و نوشیدنیهای قندی.
در مواردی مانند پانکراتیت مزمن پزشک ممکن است مصرف پانکراتیک آنزیمها (قرص یا پودر مکمل) را توصیه کند تا کمک به هضم غذا نمایند. همچنین، رژیمهای حاوی ویتامینهای A، D، E و K و مکملهای آنتیاکسیدان میتوانند برای ترمیم سلولهای پانکراس مفید باشند.
در مواردی که هدف پیشگیری از التهاب یا سرطان پانکراس است، رعایت این رژیم همراه با ترک سیگار و الکل، حفظ وزن مناسب و کنترل قند خون بسیار موثر است.
پانکراس و قند خون
پانکراس و قند خون پیوندی ظریف و شگفتانگیز دارند؛ همچون دو تار از یک ساز که اگر یکی از کوک بیفتد، نغمه بدن نیز بینوا میشود. در دل پانکراس، مجموعهای از سلولها به نام جزایر لانگرهانس پنهان هستند که پاسداران تعادل قند خوناند. سلولهای بتا هنگام بالا رفتن خون، هورمون انسولین را آزاد میکنند؛ انسولین همان کلید ورود قند به سلولهاست تا بتوانند آن را برای تولید انرژی بسوزانند یا در کبد و عضله به صورت گلیکوژن ذخیره کنند.
در شرایط ناشتایی یا گرسنگی سلولهای آلفا وارد میدان میشوند و هورمون گلوکاگون را ترشح میکنند. گلوکاگون پیام میدهد که ذخایر کبد را آزاد کند و گلیکوژن را به گلوکز بدل نماید تا خون از افتادن به دره کمقندی در امان بماند. انسولین و گلوکاگون در هماهنگی کامل عمل میکنند، یکی نگاهدار آرامش پس از غذا، دیگری نگهبان بیدارِ ساعات گرسنگی.
هرگاه این هماهنگی از بین برود (بهعنوان مثال، سلولهای بتا آسیب ببینند یا بدن نسبت به انسولین مقاوم شود) قند خون بالا میرود و دگرگونیهای سختی رخ میدهد که آغاز اختلالات دیابتی است. بنابراین سلامت پانکراس یعنی توانایی بدن در حفظ این تعادل لطیف میان فراگیری و رهاییِ قند؛ همان نظمی که زندگی هر سلول از آن نیرو میگیرد.
نگاه پایانی: پیچیدگی کنترل متابولیک
پانکراس چشم ناپیدای نظم سوخت بدن است؛ جایی میان دو قطب سیری و گرسنگی، انرژی و خواب، بیداری و فرسودگی. عملکرد آن صرفا یک سیستم روشن/خاموش نیست، بلکه یک سیستم تناوبی، حساس و دارای بازخوردهای منفی متعددی است که شامل تنظیمات هورمونی، عصبی و متابولیکی در سطح مولکولی میشود.
از انسولین آرام و نگهدارنده که سلولها را برای استفاده از گلوکز آماده میسازد، تا گلوکاگون هشداردهنده و آزادساز که از فروپاشی انرژی جلوگیری میکند، تنظیم قند خون داستانی از هماهنگی تضادهاست. همین تعادل ظریف است که انسان را در مرز سلامت نگه میدارد و هر بار که این مرز فرو میریزد، پزشکی را فرامیخواند تا دوباره این آفرینش موزون را کوک کند. درک عملکرد این دو هورمون کلیدی، سنگ بنای درمان و پیشگیری از شایعترین اختلال متابولیک جهان، یعنی دیابت، محسوب میشود.



یک نظر
[…] مزمن پانکراس (که مشخصه پانکراتیت مزمن است) یک وضعیت سیستمیک است که […]